De Japón a México: de neurotoxinas en venenos de arañas y de otros animales ponzoñosos
Gerardo Corzo Burguete
Palabras clave: toxinología, insecticida, canales de sodio dependiente de voltaje, similitud estructural, antivenenos, alacrán, elápidos
En julio del año 1997, al terminar mis estudios de doctorado (el equivalente en universidades estadounidenses como Philosophy Doctor o PhD), pero en Ciencia de los Alimentos (Food Science), llegó el ineludible día en que debía buscar un empleo relacionado a lo aprendido en el área de microbiología de bacterias lácticas, que fue el tema de mi proyecto de doctorado. En aquel entonces deseaba trabajar en un ambiente empresarial, o en uno académico, lo que llegara primero; así fue como envié cerca de 100 solicitudes de trabajo a diferentes empresas y universidades.
Aunque hubo varios contactos prometedores, éstos desafortunadamente no llegaron a cristalizar. Sin embargo, hubo una empresa que se interesó en mi historial académico porque, durante mi doctorado, había hecho investigación sobre enzimas de bacterias lácticas. El trabajo se relacionaba al uso de enzimas endo·proteolíticas, o endo·peptídicas -que son las que rompen internamente proteínas-, como un método para descifrar las estructuras primarias (el orden lineal de los aminoácidos) de otras proteínas.
Mi estancia en Oriente
La ubicación de esta empresa se encontraba en la Ciudad de Osaka, Japón, así que siendo un tema de interés científico al cual no me había enfrentado, acepté el trabajo. Un factor también importante en esa decisión fue el haber tenido una muy buena experiencia académica en los años 89-90 realizando una especialidad en Biotecnología Marina en ese país asiático. De modo que su gastronomía y sus costumbres sociales no serían una dificultad social que afectara mi desempeño científico/ laboral.
El empleo era ofrecido por la empresa Suntory Institute for Bioorganic Research (SUNBOR) para trabajar bajo la dirección del Dr. Pierre Escoubas (investigador francés), y el Dr. Terumi Nakajima (emérito de la Universidad de Tokio), para la búsqueda de proteínas que tuvieran actividad insecticida y provinieran del veneno de arañas. Este objetivo sería una tarea común entre SUNBOR y la American Cyanamid Company. En ese entonces, esta última era una empresa líder en fertilizantes, insecticidas y en productos farmacéuticos, de la cual una división fue finalmente comprada por Pfizer, extinguiéndose como corporación.
En el transcurso de los proyectos en Osaka, en congresos relacionados a la toxinología, que es el estudio de venenos de animales ponzoñosos, llegué a conocer a los Dres. Alejandro Alagón y Lourival Possani, y fue cuando con apoyo de ambos colegas fui repatriado a nuestro país.
Estructura y efectos de las neurotoxinas de arañas
Fue así como los resultados de la investigación en SUNBOR, en complemento con el trabajo en el Instituto de Biotecnología (IBt), se volvieron clave en la elucidación de estructuras moleculares de las neurotoxinas presentes en venenos de arañas y que también interactúan con unas macromoléculas fascinantes llamadas “canales iónicos” (porque dejan pasar o no, algunos iones). En particular, para las neurotoxinas de arañas, aquellos que transportan iones de sodio (Na+) y que son ‘dependientes de voltaje’, en clave abreviada: Nav.
Hablaremos aquí de esos ‘poros’ de naturaleza proteica que, en las células con funciones sensoriales o motoras (nerviosas y musculares), se encuentran insertados a través de la membrana plasmática de las células, para controlar los flujos —asimétricos, pero en equilibrio dinámico— de varios tipos de átomos cargados (iones), de sodio, potasio, cloro y calcio; [ver art. 32.1 de L. Possani en este mismo número]. Sin olvidar que este conocimiento es importante para conocer mejor la biodiversidad y también para prevenir o remediar casos de envenenamiento.
Una vez que me integré al consorcio de investigación y desarrollo, formé mi propio grupo de investigación en el IBt, descubrimos una familia de neurotoxinas insecticidas en los venenos de araña y comparamos sus secuencias con las correspondientes neurotoxinas insecticidas en los venenos de alacranes. Aunque ambos son arácnidos y están emparentados por ancestros comunes, las arañas y los alacranes son claramente distinguibles entre sí. En los venenos de estos arácnidos encontramos que la identidad o similitud entre las estructuras primarias de arañas y alacranes es bastante diferente (son como textos cortos con palabras faltantes o letras cambiadas).
Entre las diferencias observadas concluímos: primero, las neurotoxinas de arañas son mucho más pequeñas; prácticamente son de la mitad de tamaño respecto de las neurotoxinas del mismo tipo en venenos de alacranes. Concretamente, la identidad de las neurotoxinas del veneno de araña solo conserva entre un 16 y un 21% de identidad con las más similares del veneno de alacranes. [Fig. 1].
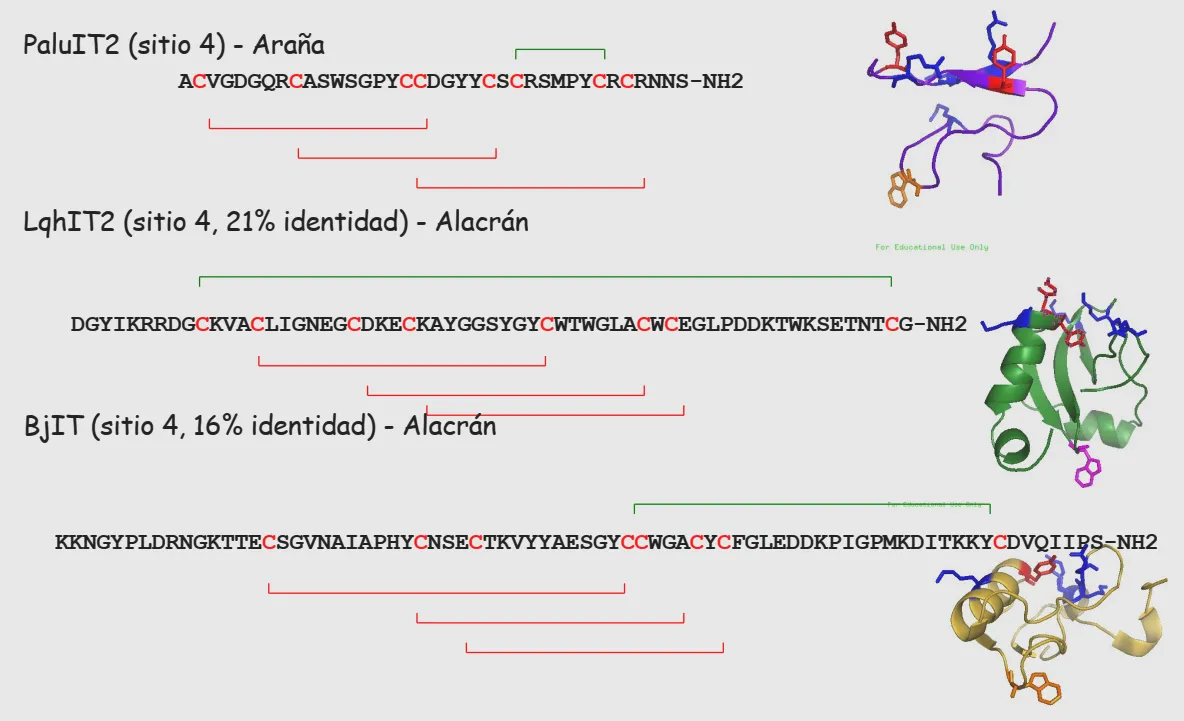
Figura 1. Estructura y similitud entre neurotoxinas insecticidas provenientes de venenos de arañas y alacranes. Se muestran las secuencias (en código de una letra por aminoácido) de las neurotoxinas de: la araña Paracoelotes luctuosus (PaluIT2) y de otras dos provenientes del veneno de los alacranes Leiurus quinquestriatus (LqhIT2) y Buthus judaicus (BjIT); el sufijo IT significa ’insecticida’ o insect toxin. A pesar de su baja sililitud, las tres neurotoxinas tienen afinidad química con el sitio 4 del canal de sodio (Nav) de insectos. Cada una de las tres neurotoxinas contienen en su estructura cuatro puentes disulfuro [-S—S-], representados con las líneas verdes y rojas) que conectan internamente a los aminoácidos de cisteína (C) y explican parcialmente su plegamiento tridimensional (Der.).
Como la identidad entre ellas realmente es muy baja, suponemos que estructuralmente no habría una relación evolutiva entre ellas (genes comunes ancestrales); no obstante, todas muestran cuatro ‘puentes disulfuro’, que son estos ‘conectores’ entre dos cisteínas (C en la secuencia lineal, o primaria) de la proteína, lo que se conoce como su estructura secundaria [Fig. 1]. Lo que es muy relevante es que ambos tipos de neurotoxinas insecticidas de los venenos de araña o de alacrán, reconocen e interactúan con un mismo sitio de unión a la molécula del canal iónico para sodio (Nav de insectos, conocido como receptor 4 o sitio 4 [Fig. 2].
Aún más interesante resulta que, comparando y sobreponiendo las estructuras tridimensionales de estas tres neurotoxinas de arácnidos, se observa que poseen algunos aminoácidos en posiciones similares, sugiriendo claramente que estos aminoácidos son importantes para reconocer dicho receptor en el Nav de insectos [Fig. 3].
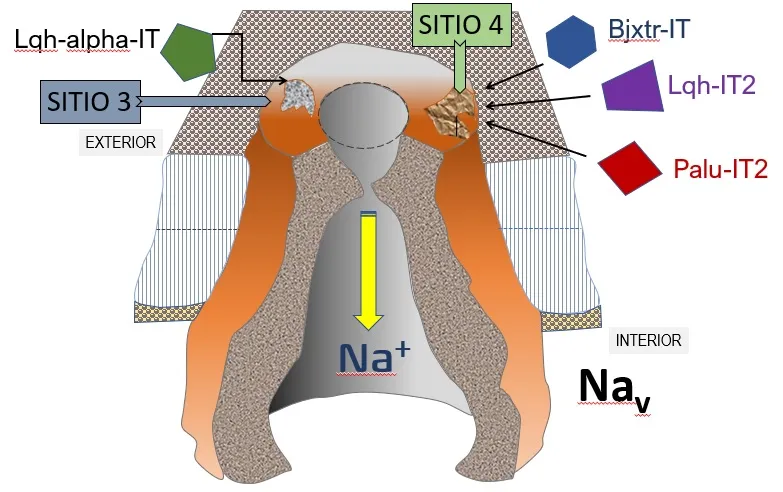
Figura 2. Esquema simplificado que ilustra las neurotoxinas de arañas (PaluIT2) y alacranes (BjxtrI y LqhIT2TB), que reconocen un mismo sitio de unión (llamado receptor o SITIO 4 de unión) en el canal iónico de sodio Nav (modelo tipo 'campana' en corte transversal), insertado en la membrana plasmática de las células blanco. Las figuras geométricas en verde, azul, violeta y rojo representan neurotoxinas. Las neurotoxinas BjIT, LqhIT2 y PaluIT2 compiten por el mismo sitio de unión al Nav. La neurotoxina Lqh-alpha-IT es una neurotoxina de veneno de alacrán que se une al SITIO-3 del Nav de insectos, y no compite con las neurotoxinas BjIT, LqhIT2 y PaluIT2. [Adaptado de: Gordon D. (1997) Invert Neurosci 3(2-3):103-16. doi: 10.1007/BF02480365].
Este fue el primer reporte de una convergencia funcional en la evolución biológica de este grupo, que implica que las neurotoxinas de arácnidos (que pertenecen la clase Arachnida, pero cuyas especies de arañas y alacranes pertenecen a órdenes taxonómicos separados), contienen en sus venenos neurotoxinas —que como suponemos, no provienen de genes homólogos, del mismo origen ancestral— en su estructura tridimensional actual, tienen afinidad por un mismo sitio del receptor. Mas adelante en años subsecuentes descubrimos neurotoxinas en una especie de la araña japonesa Macrothele gigas, que también interacciona con el sitio 4 de los Nav, pero al correspondiente de células de mamíferos, el cual sustancialmente distinto a los Nav de insectos. Encontramos además en el veneno de M. gigas, una neurotoxina que se une a otro sitio en los canales Nav de mamíferos (SITIO 3, Fig. 2). Las neurotoxinas de este tipo eran solo conocidas en venenos de arañas australianas de este grupo, y por ello publicamos este caso como lo que podría representar una ‘analogía evolutiva’. Propusimos allí que, a partir de dos orígenes distintos —tanto geográfico como genético— se han seleccionado neurotoxinas en los venenos de estas arañas por un mismo sitio en los Nav de mamíferos [Fig. 2].
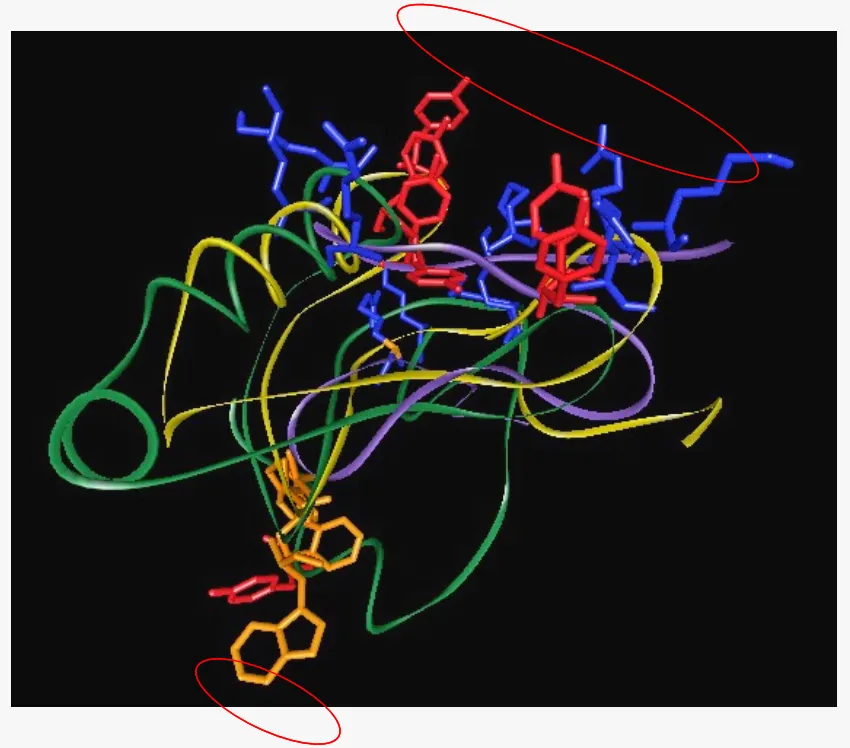
Figura 3. Modelo molecular ‘empalmado’ de las cadenas polipeptídicas de las neurotoxinas de araña (violeta) y de alacranes (verde y amarillo), que reconocen el receptor 4, o sitio 4, de los canales de sodio (Nav). Se aprecia que contienen algunos residuos de aminoácidos similares (estructuras geométricas cercanas a círculos rojos), y que son importantes para reconocer e interactuar con el Nav. [Fuente: G. Corzo].
Investigación y síntesis de otros venenos
Posteriormente, nos centramos en el análisis de venenos de alacranes y de arañas presentes en América, principalmente de los géneros Centruroides y Brachypelma, respectivamente. Con el apoyo de la Dra. Georgina Estrada —mi primera estudiante de doctorado y con sus conocimientos en biología molecular— logramos generar neurotoxinas recombinantes, inicialmente de alacranes y seguidamente de arañas. Aislamos los genes que las codifican y, con el uso de cultivos bacterianos modificados y utilizados como ‘sistemas de expresión de proteínas’, produjimos éstas en biorreactores. Para este trabajo, ha sido fundamental la participación de la Dra. Herlinda Clement (técnica académica asociada al laboratorio), quien ha impulsado el trabajo de ‘construcción’ de los genes recombinantes de neurotoxinas con las que hemos trabajado.
Nuevas aplicaciones que vamos generando
Nuestra labor académica se ha dirigido a generar conocimiento sobre neurotoxinas y proteínas de serpientes de varias especies de elápidos y vipéridos; [ver art. 32.5 de E. Neri en este número]) y de insectos como las chinches (familia redúvidos). La producción de proteínas recombinantes en estos ‘sistemas de expresión microbianos’ es una práctica frecuente hoy en día, debido a la gran cantidad y diversidad de información y recursos utilizables a nivel genético, así como la infraestructura para el análisis químico y la purificación de proteínas.
No obstante, existe un problema en varios casos, ya que el ‘plegamiento’ de las proteínas recombinantes fuera de su ambiente natural, no es azaroso; es decir, el doblamiento o acomodo (folding) correcto de las cadenas de aminoácidos en el espacio (de lo que depende su función), solo ocurre en las condiciones donde normalmente se biosintetiza la proteína nativa. Esto sucede en células especializadas como las glándulas de veneno de animales ponzoñosos. Existen otros factores ausentes en cultivos bacterianos y por tanto se debe recurrir a sistemas de producción con cultivos de células animales, [ver art 32.7 de Palomares y cols. en este número].
Sin dejar de avanzar en la biosíntesis de proteínas recombinantes, también realizamos la síntesis química de proteínas pequeñas. Generamos los péptidos de las toxinas, uniendo químicamente aminoácidos con técnicas in vitro). Ambos tipos de síntesis de proteínas y de péptidos son complementarios para el trabajo que realizamos en el laboratorio. Así, estas moléculas nos han servido para obtener cantidades suficientes de algunos componentes de los venenos, para experimentar y confirmar hipótesis —llamadas pruebas de concepto— de posibles usos aplicados como insecticidas o como posibles biomedicamentos. En los casos exitosos, nos ha llevado a solicitar la protección de derechos de propiedad intelectual (inventos, patentes y otras alternativas), a favor de la UNAM, de las cuales ya nos han concedido varias [ver, BiotecMov 29.5 ] .
Con base en las estrategias del consorcio de I&D, un ejemplo es la patente que cubre la creación de una secuencia de ADN para producir una neurotoxina sintética que es representativa y activa, considerando la mayoría de las neurotoxinas de serpientes del grupo de los elápidos; en éste se incluyen principalmente al coralillo de América, las mambas de África, las cobras en Asia y las taipanes de Australia.
Lo interesante de esta estrategia, es que la estructura y toxicidad de las neurotoxinas en estos especímenes prácticamente no han cambiado a lo largo de diferentes regiones geográficas —como sí ha ocurrido con las neurotoxinas de arácnidos— por lo que ésta estructura ‘consenso’ de proteína neurotóxica, nos permite utilizarla como un antígeno para producir antídotos contra la mordedura de serpientes de diferentes regiones del mundo. Esta cobertura mundial ha mejorado la efectividad, seguridad y acceso a los antivenenos y tratamientos actuales contra estas situaciones.
Adicionalmente, los venenos y secreciones salivales de varios insectos, arácnidos y otros animales ponzoñosos, son vistos como una fuente rica y diversa de componentes con aplicaciones que pueden ser benéficas para los humanos. Un ejemplo son los péptidos antimicrobianos (PAM) que, por su tamaño y carga, podrían utilizarse para tratar las infecciones causadas por bacterias multirresistentes a los antibióticos. Otro ejemplo ha sido una proteína pequeña a la cual denominamos Osu1 —que fue aislada, caracterizada y descrita en nuestro grupo, a partir de del veneno de la araña Ocuilosa supermirabilis— que mostró actividad insecticida; ver [ BiotecMov 26:16-17 ].
No obstante, después se encontró una actividad directa de este péptido, sobre un receptor de membranas —ahora sabemos que es el canal iónico denominado hKv1.5, el cual se encuentra en células del corazón humano. El funcionamiento anormal de este canal iónico (involucrado en el transporte de iones a través de membranas celulares y la contracción muscular asociada), puede generar enfermedades cardiacas como la fibrilación atrial o arritmia, por lo que existe gran interés en aprovechar moléculas con funciones regulatorias de este canal iónico en particular.
En resumen, nuestro trabajo forma parte de proyectos activos de investigación sobre venenos de animales —como de alacranes, arañas y reptiles, entre otros— que involucra la formación de recursos humanos, caracterizando las funciones biológicas de nuevas proteínas; esto con el objetivo de desarrollar posibles aplicaciones biotecnológicas que abonen al fortalecimiento de la medicina molecular y a un desarrollo sustentable de los bioprocesos involucrados.
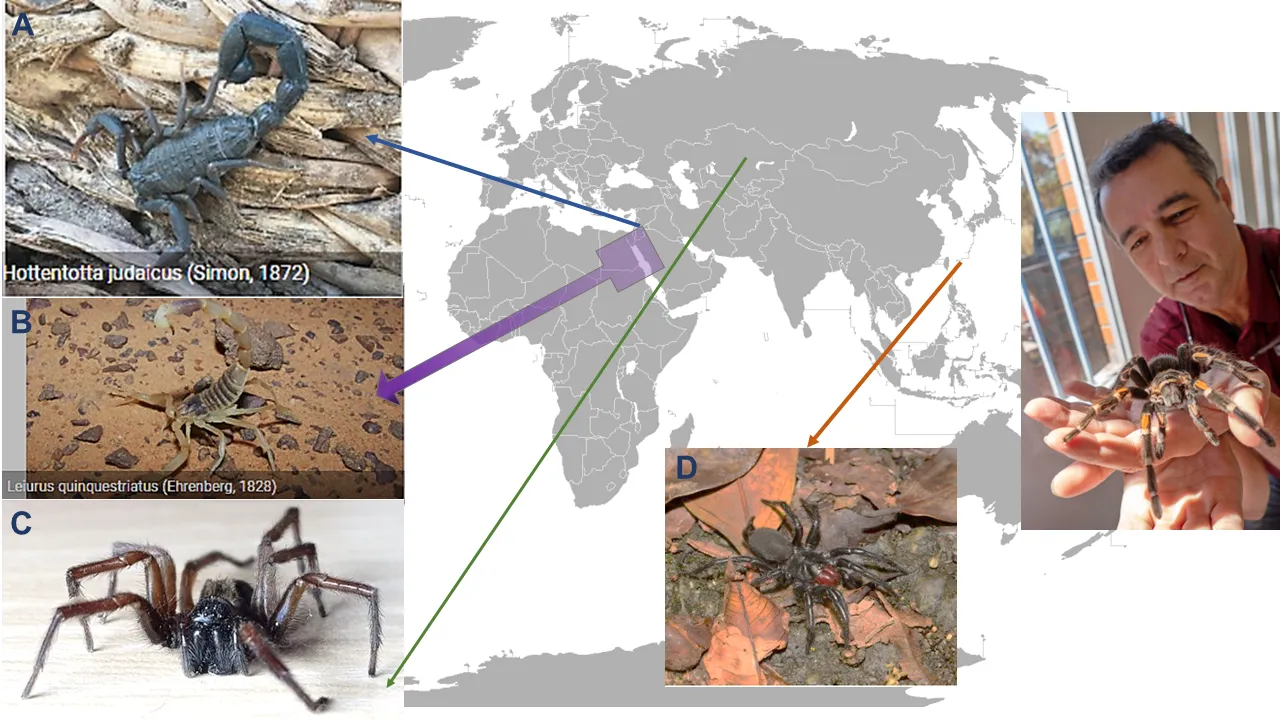
Figura 4. Ubicación de ejemplares reportados de arácnidos fuente de las neurotoxinas (A) Bjl·IT/ Bj·xtr [de Buthus judaicus = Hottentotta judaicus]; (B) Lqh·IT2 y Lqh-alpha·IT [de Leiurus quinquestriatus] y (C) Palu·IT2 [de Paracoelotus luctuosus = Pireneitega luctuosus]. También se muestra (D), un espécimen de Macrothele gigas (araña japonesa) y al Dr. Corzo presumiendo una tarántula. [Fuente: Global Biodiversity Information Facility [GBIF
Lecturas sugeridas o de referencia
- De la Rosa G, LL Corrales-Garcia, X Rodriguez-Ruiz, E Lopez-Vera & G Corzo (2018). Short-chain consensus alpha-neurotoxin: a synthetic 60-mer peptide with generic traits and enhanced immunogenic properties. Amino Acids. 50 (7): 885-895. DOI:10.1007/s00726-018-2556-0
- Estrada G, E Villegas, G Corzo (2007). Spider venoms: a rich source of acylpolyamines and peptides as new leads for CNS drugs. Natl Prod Rep 24 (1): 145-161. DOI:10.1039/B603083C
Comparte este artículo en redes sociales

Acerca de los autores
El Dr. Gerardo Alfonso Corzo Burguete es Investigador Titular C y Líder Académico del IBt, forma parte del Consorcio de investigación sobre animales venenosos.
Contacto: gerardo.corzo@ibt.unam.mx






